


1、基本信息:
药品名称:贝美前列素、比马前列素、卢美根
英文名称:Bimatoprost
化学名称:(Z)-7-[(1R,2R,3R,5S)-3,5-二羟基-2-[(E,3S)-3-羟基-5-苯基戊-1-烯基]环戊基]-N-乙基庚-5-烯酰胺
结构式:
分子量:415.57
CAS号:155206-00-1
分子式:C25H37NO4
剂型及规格:滴眼液
中国只有原研进口一家,0.03%滴眼液 (3mL:0.9mg,5mL:1.5mg),Allergan
Bimatoprost 0.3 mg/ml eye drops, solution(Aspire Pharma Ltd,仿制)
适应症:用于降低开角型青光眼或高眼压症患者的眼压;
促进睫毛生长,治疗睫毛稀少症状;
申报类别:化药4类
原研进口:贝美前列素单方滴眼液已上市,贝美前列素和噻吗洛尔的复方正在中国做临床
现国内有上海恒瑞、湖北远大天天明、武药制药、天津信汇等在研,仿制药未上市。
2、产品概述:
简介:贝美前列素是爱力根(Allergan)公司开发的一种前列腺素(PG F2α)类药物,它是一种合成的前列酰胺,是2001年美国FDA批准的局部眼用制剂,迄今已在全球几十个国家上市销售。
比马前列素目前批准上市的共有两个品牌,分别是Lumigan和Latisse。Lumigan被认为是目前降IOP作用最强的局部抗青光眼药物。Latisse则是全球唯一获得FDA认证的睫毛增生液。2010年8月,美国FDA批准了Allergan有限公司开发的0.01%比马前列素(bimatoprost)滴眼液Lumigan0.01%,随后0.03%退市。
复方比马前列素(bimatoprost)/噻吗咯尔(timolo1)0.03%/0.5%滴眼液(商品名:Ganfort)上市,用于治疗青光眼。
药理:贝美前列素是一类高效能的PGF2α类降眼压药物,是一种合成的前列腺素酰胺类,具有很强的降眼压作用,通过水解为游离酸后作用于FP类前列腺素受体,从而治疗青光眼。贝美前列素具有双重降眼压机制,可以通过增加小梁网通道和葡萄膜巩膜通道的房水流出,并降低表层巩膜静脉压而降低眼内压(IOP);同时PGF2α具有很强的夜间降压效果,尤其适用于NTG的治疗,能有效控制昼夜眼压波动(眼压波动范围<3.6mmhg),保持眼压稳定,减少眼压波动对视功能的影响。
市场:青光眼是全球第二位的致盲因素,也是我国第二大眼科常见疾病,约占眼科疾病的14。36%。青光眼人群中的发病率约为0。12%~1。64%。随着老龄化和上网时间增加,青光眼和白内障发病率将增大,该类药物的前景十分看好。
3、专利:
化合物及0.03%滴眼液制剂专利US5688819和US6403649分别于2014\2012年过期。
0.03%睫毛制剂及用途专利US8038988 2022年到期,中国专利CN102271654B 复审
0..01%滴眼液 制剂及用途专利US7851504 ,2025年到期,中国同族CN101137383,CN101137383 及CN102240292 已授权2026到期
其他专利贝美前列素酸的晶型专利,用途专利等
4、合成路线:
参考US5688819 US6403649,JP59128370;CN102875586,WO2014/040457及国内外合成文献报道,合成路线如下:
储存条件(参照原研):stored in a refrigerator at 2~8°C and protected from light is justified.
5、质量标准
分析方法:本品未收入药典,参照曲伏前列素(USP),拉坦前列素(USP)等,杂质信息:Bimatoprost acid;13,14-Epoxide derivative;15-epi Diastereomer;5,6-trans Isomer;15-Keto derivative等,为工艺杂质和降解杂质,可通过合成工艺获得。
其他关键指标包括含量,残留溶剂,旋光,水分等
6、制剂信息:

处方List of excipients:
Benzalkonium chloride(0.2mg/ml),Sodium chloride,Sodium phosphate dibasic heptahydrate
,Citric acid monohydrate,Sodium hydroxide or hydrochloric acid, concentrated (to adjust the pH)
,Water for injection
美国申报情况: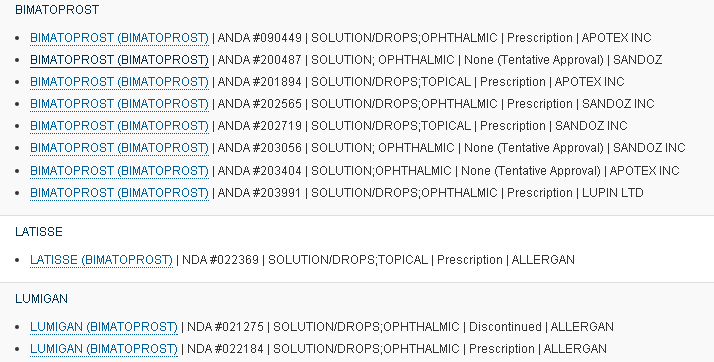
6.周期:
开发周期:
合成小试,质量分析方法的建立与验证,制剂小试,杂质对照品的制备:6+2个月;
原料药和制剂的中试与验证: 2+1+1个月;
稳定性考察和注册:6~12个月
共计约18~24个月