


一、MAH业务介绍
药品上市许可持有人是指取得药品注册证书的企业或者药品研制机构等。
药品上市许可持有人制度(MAH)的核心内容是药品批准文号和生产许可脱离,允许试点的药品研发机构和科研人员取得药品的批准文号,并且对药品质量承担相应的责任。MAH出台之前,我们国家实行的是上市许可和生产许可统一捆绑的管理模式,只有生产企业才可以来申请药品注册,取得最终的药品批准文号。
MAH制度出台之前,我国也有相似的制度:委托生产制度和技术转让制度。
值得注意的是,委托生产制度并不是生产许可和上市许可唯一准入制度下面的一个产物,根据现在的委托生产的规定,只能委托生产企业有这个批准文号的企业来委外,也是委托方和受托方均为生产企业,而且本身的批准文号是不随委托进行变更的。可以说,委托生产本身只是在持有企业拥有技术改造等不具备生产条件下的暂时性的安排。
MAH在国际社会其实早已通行,主流的发达国家和地区普遍采取了药品上市许可持有人制度。
二、项目工作流程
我公司作为第一批较早取得生产许可的研发机构,依托专业的实验室及认证咨询团队,具备丰富的申报经验。针对不同类型的客户,可提供定制化服务,帮助客户建立或优化质量管理体系,优化人员配置,打通申报通道,使得客户能够在最短的时间内取得药品生产许可。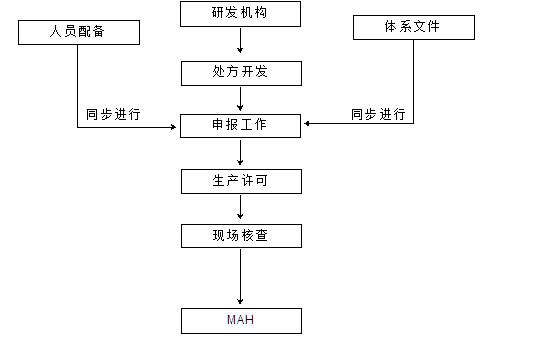
三、成为药品上市许可持有人需要准备的资料清单一览
药品上市许可持有人委托他人生产的情形
1.药品生产许可证申请表;
2.基本情况,包括企业名称、拟生产品种、剂型、工艺及生产能力(含储备产能);
3.营业执照(申请人不需要提交,监管部门自行查询);
4.组织机构图(注明各部门的职责及相互关系、部门负责人);
5.法定代表人、企业负责人、生产负责人、质量负责人、质量受权人及部门负责人简历、学历、职称证书和身份证(护照)复印件;依法经过资格认定的药学及相关专业技术人员登记表,并标明所在部门及岗位;高级、中级、初级技术人员的比例情况表;
6.拟委托生产的范围、剂型、品种、质量标准及依据;
7.拟委托生产剂型及品种的工艺流程图,并注明主要质量控制点与项目、受托方共线生产情况;
8.生产管理、质量管理主要文件目录;
9.药品上市放行规程;
10.委托协议和质量协议;
11.持有人确认受托方具有受托生产条件、技术水平和质量管理能力的评估报告;
12.受托方相关材料
(1)受托方药品生产许可证正副本复印件;
(2)受托方药品生产企业的场地、周边环境、基础设施、设备等情况说明;
(3)受托方周边环境图、总平面布置图、仓储平面布置图、质量检验场所平面布置图;
(4)受托方生产工艺布局平面图(包括更衣室、盥洗间、人流和物流通道、气闸等,并标明人、物流向和空气洁净度等级),空气净化系统的送风、回风、排风平面布置图,工艺设备平面布置图;
(5)受托方空气净化系统、制水系统、主要设备确认或验证概况;生产、检验仪器、仪表、衡器校验情况;
(6)受托方主要生产设备及检验仪器目录;
(7)受托方药品出厂放行规程;
(8)受托方所在地省级药品监管部门出具的通过药品GMP符合性检查告知书以及同意受托生产的意见;
13.申请材料全部内容真实性承诺书;
14.凡申请企业申报材料时,申请人不是法定代表人或负责人本人,企业应当提交《授权委托书》;
15.按申请材料顺序制作目录。
四、重要的先决条件
1. 研发机构或企业;
2. 配备足够的人员;
3. 建立完整的体系。