


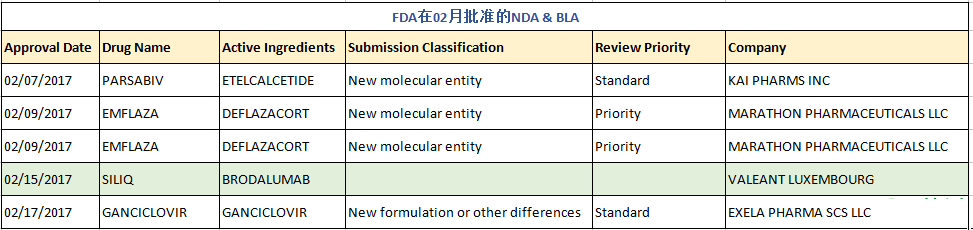
在刚过去的2月里,FDA共批准了4个新药申请(NDA)、1个生物制品申请(BLA)及45个仿制药申请(ANDA,不含6个预批准药物),其中包括了5个首仿药,后有详细清单。
1
生物制品申请BLA
Siliq
Siliq是由FDA于2017年02月15日批准的用于治疗中度至重度斑块性银屑病的IL-17单抗药物,活性成分为Brodalumab,批准规格为210mg/1.5ml,被批准公司为瓦兰特(Valeant)制药公司。这是第三款IL-17单抗抑制剂,也是一种新颖的IL-17受体的抑制剂。Brodalumab曾于2016年07月04日就已获得日本医药品医疗器械综合机构(PMDA)批准上市,被批准公司为日本协和发酵麒麟株式会社,商品名为Lumicef®。

白细胞介素17 (IL-17)在1993年首次被科研人员发现,随后的研究发现IL-17在宿主防御、自身免疫性疾病发病以及肿瘤中发挥重要的作用。迄今为止,己有六个IL-17家族成员被发现:IL-17A、IL-17B、IL-17C、IL-17D、IL-17E和IL-17F,IL-17是IL-17家族的原型。Siliq的活性成分Brodalumab是一种新颖的IL-17受体的抑制剂(单克隆抗体),能选择结合IL-17受体并阻止其与IL-17A、IL-17F及其它类型IL-17的结合,避免机体收到可能导致炎症的信号,从而抑制银屑病相关炎症的应答反应。
Brodalumab最初由安进(Amgen)研发,后有临床数据显示Brodalumab与患者自杀倾向相关,于是放弃了Brodalumab这个一度曾被认为能“快速通过FDA审批和上市,并有望成为潜在的重磅产品”。之后阿斯利康(AstraZeneca)和日本协和发酵麒麟株式会社(Kyowa Hakko Kirin)获得了该药的研发授权。然而,在最后关头AstraZeneca也不要Brodalumab,便与Valeant制药公司达成合作,将Brodalumab的开发及商业化独家权利授权给Valeant。因此,Valeant最终拥有Brodalumab除了日本及其他一些亚洲国家(这些地区由Kyowa Hakko Kirin持有)的开发及商业化的全球独家权利。
Brodalumab是第三款IL-17抗体抑制剂。早在2015年01月15日,诺华(Novartis)就已分别获得EMA和FDA批准的单抗新药Secukinumab,是第一个上市的IL-17抑制剂。随后,2016年03月22日礼来(Eli Lilly)获得FDA批准的全球第二款IL-17A单抗抑制剂Ixekizumab,并于2016年04月25日获得EMA的批准上市。因此,即使Brodalumab在斑块状银屑病和银屑病性关节炎两个疾病治疗方面表现出不俗的疗效,预估获批后也前景黯淡。而Valeant此次接盘Brodalumab,非常符合该公司赌徒一般的行事风格。
2
新化学药NDA
PARSABIV
Parsabiv为FDA于2017年02月07日批准的用于治疗血液透析慢性肾脏病(CKD)成年患者继发性甲状旁腺功能亢进(sHPT,简称继发性甲旁亢),是一种拟钙剂,活性成分为Etelcalcetide,是首个在每次透析结束时可通过静脉注射给药的拟钙剂,批准规格为2.5mg/0.5ml、5mg/ml和10mg/2ml,被批准公司为KAI PHARMS INC(于2012年以3.15亿美元被Amgen收购)。该产品曾于2016年08月被FDA否决,却于2016年11月11日获得欧洲药品管理局(EMA)人用药品委员会(CHMP)的批准上市(Amgen Europe B.V.),最终又于本月07日获得FDA的批准。Parsabiv是安进(Amgen)公司第二个重磅级用于治疗透析CKD患者的继发性甲旁亢症的药物。
慢性肾脏病(CKD)是各种肾脏病于急性阶段未经控制后的共同转归,近年来患病率有明显上升趋势,是全世界重要的公共健康问题。流行病学调查数据显示,2011年美国成人CKD患病率已高达15.1%,我国目前CKD患病率为10.8%。透析患者的依从性和长期生存质量不高,每年透析死亡率仍高过20%。CKD长期透析死亡原因主要是慢性并发症,其中继发性甲旁亢又是早发、多发,危害大、治疗难度大的一个并发症,是CKD患者最常见且最严重的并发症之一。
早在2004年03月,Amgen就已获得FDA批准的重磅级用于治疗透析CKD患者的继发性甲旁亢的新药SENSIPAR(普通口服片剂:30mg,60mg & 90mg),在2015年依旧获得了逾14亿美元的销售额,但现在开始面临仿制药的竞争,SENSIPAR仅有大约25%的市场保护,主要与其依从性问题相关,该药物需要每天服用。Parsabiv在透析期间输注使用,从而回避了依从性问题。Parsabiv被预测可以与SENSIPA相媲美,甚至可能会超过SENSIPA,临床试验表明,Parsabiv用于继发性甲状旁腺机能亢进时在降低甲状旁腺素水平方面与SENSIPAR一样好,就经历高水平响应的患者人数来说,它比SENSIPAR有效。
Parsabiv是Amgen公司SENSIPAR的后继产品,去年公布的III期数据显示,Parsabiv疗效轻松击败SENSIPAR。Amgen研发执行副总裁Harper称:“对于任何口服药物,治疗依从性都可能是一种挑战,如果继发性甲状旁腺机能亢进控制不好,疾病可能会进展,并可能有重大临床后果。通过使用Parsabiv,我们可以帮助确保这些患者获得这一重要治疗药物,作为他们每周三次透析的一部分”。全球大约有200万人因肾衰竭而进行透析,继发性甲状旁腺机能亢进是其一种频繁的并发症,分析师称Parsabiv有巨大的销售潜能。
EMFLAZA(老药新用)
孤儿药EMFLAZA为专注于罕见病新药研发的美国马拉松制药公司Marathon Pharma于2017年02月09日获得FDA批准的两个制剂产品:片剂(四个规格6mg,18mg,30mg和36mg)和混悬剂(22.75mg/ml),活性成分为地夫可特(Deflazacort),用于治疗5岁及以上杜氏肌营养不良症(DMD,也称假肥大性肌营养不良)患者。DMD是一个致命的儿童罕见病,因而Emflaza获得了孤儿药、优先审批、优先审批评审券等特殊待遇。
DMD是一种由编码抗肌萎缩蛋白(dystrophy)基因突变所致的x-连锁隐性遗传性肌病,有约三分之一病例为散发,没有家族史,是由基因突变造成。患者出生时多正常无异样,自1岁以后开始逐渐出现站立和行走困难,到10岁时已不能行走、需要使用轮椅生活,大多数患儿最终卧床不起,并发痉挛、褥疮、肺炎而在20岁前死亡。DMD一般为男孩发病,全世界活产男性新生婴儿中的发病率约为1/3600,但是在极少数情况下,女孩也会得这种病。
Deflazacort是一个很老的糖皮质激素,其主要作用是肾上腺皮质机能减退、自身免疫性疾病、过敏性疾病及血液系统疾病等,常被用于过敏性疾病。很多国家都有廉价仿制产品(如我国浙江仙琚、天津天药),但从未在美国上市。EMFLAZA是继Exondys 51(由Sarepta公司于2016年09月19日获批两个规格口服液)后美国批准的第二个DMD药物,FDA之所以批准Emflaza是基于20多年前做的一个研究:196名患者使用Emflaza肌肉力量有所改善。EMFLAZA只是缓解DMD患者症状,没有亚型限制,因此Emflaza适用人群远大于Exondys51(只适用13%患者)。“Emflaza是首款获批用于治疗广大DMD患者的药物,”FDA药品评价与研究中心的神经病学产品部主任Billy Dunn博士说。“我们希望该治疗选择会使许多DMD患者获益。”
GANCICLOVIR
GANCICLOVIR为FDA于2017年02月17日批准的用于免疫损伤引起巨细胞病毒感染的患者(如如艾滋病患者)的注射剂,活性成分为更昔洛韦(Ganciclovir)批准规格为2mg/ml,被批准公司为Exela制药公司。
3
仿制药
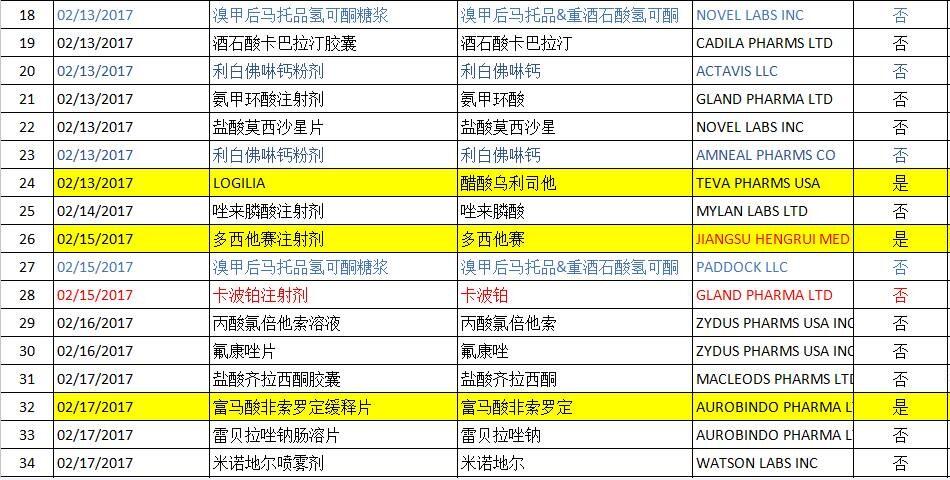
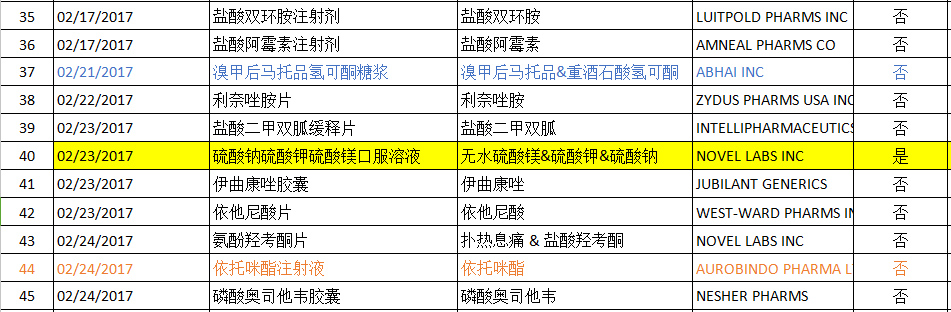
2017年02月FDA共批准ANDA药物有45个(后面附详细图表),其中印度Aurobindo公司为大赢家,有5个产品获得批准,其中1个为首仿产品;迈兰(MYLAN)也有5个产品获得批准(无首仿产品),数量与Aurobindo持平。溴甲后马托品氢可酮糖浆获得批准的公司最多,达到3个;利白佛啉钙粉剂、奥沙利铂注射剂、卡波铂注射剂、匹伐他汀钙片、依托咪酯注射液均有两个公司获得批准;其余产品均只有一个企业获得批准。
CEFIXIME(头孢克肟干混悬剂)
头孢克肟为口服用的第三代头孢菌素类抗生素,适用于治疗敏感菌所致的呼吸、泌尿和胆道等部位的感染。本次Belcher公司获得两个头孢克肟干混悬剂的批件,除了常规的100mg/5ml和200mg/5ml外,还获得了500mg/5ml规格的批准,活性成分均为头孢克肟(Cefixime)。Lupin公司于2013年02月首次获得该规格的FDA批准文件,因此,对于500mg/5ml规格来说,Belcher的也算是首仿了。
LOGILIA(醋酸乌利司他片)
醋酸乌利司他是一种新型的紧急避孕药,主要通过抑制或延迟排卵而发挥紧急避孕作用。与目前常用的紧急避孕药左炔诺孕酮相比,醋酸乌利司不仅能在妇女无保护性交后长达120h内用药,且紧急避孕效力不会随用药时间延迟而下降,同时安全性和耐受性均很好,因此它的临床适用性更广,具有能够预防更多意外妊娠的潜力。醋酸乌利司他片的原研为HRA公司,商品名为ELLA,于2009年05月率先获得EMA的批准,又2010年08月13日获得FDA的批准,批准规格为30mg,Teva公司于本月13日首次仿制其30mg产品,并于当日获得FDA专利申请。
DOCETAXEL(多西他赛注射剂)
多西他赛(Docetaxel,也叫多西紫杉醇)属于紫杉类化合物抗肿瘤药中的一种,主要治疗晚期乳腺癌、卵巢癌、非小细胞肺癌,对头颈部癌、小细胞肺癌;对胃癌、胰腺癌、黑色素瘤等也有一定疗效。Taxotere(多西他赛注射剂)于1995年在首次墨西哥上市,原研公司为Aventis(安万特,2004年被赛诺菲收购),1995年11月获得EMA的批准上市,1996年05月获得FDA的批准上市,到现在为止已在英、美、法、意、德、日等主要国家上市,并有多种规格。随后,Sandoz、Pfizer等7个公司陆续开发多个新规格并上市,Teva、DR REDDYS和DFB分别仿制了其中的几个规格,江苏恒瑞医药于2017年02月15日首次仿制其中的40mg/ml注射剂。
FESOTERODINEFUMARATE(富马酸非索罗定缓释片)
富马酸非索罗定是一个治疗膀胱过度活动综合征的前体药物,进入体内后转换为一个毒蕈碱受体拮抗剂的活性代谢物5-HMT,可用于膀胱过度活动症(OAB)患者尿频、尿急、尿失禁或所有这些症状组合的治疗。富马酸非索罗定缓释片的原研公司为辉瑞(Pfizer),商品名为Toviaz,于2007年04月20日获得EMA的批准上市,于2008年10月31日获得FDA的批准上市,批准规格为4mg & 8mg。可能因专利问题,早在2015年04月末至05月初,就有Alembic、Lupin、Sun等8家公司先于获得预批准(但直到现在还未上市),而本次AUROBINDO公司获得批准的同时获得FDA专利的申请批准。
SODIUMSULFATE, POTASSIUM SULFATE AND MAGNESIUM SULFATE(硫酸钠硫酸钾硫酸镁口服溶液)
电子结肠镜现已成为大肠疾病诊断和治疗的重要方法之一,肠镜检查能否顺利完成,术前肠道准备起着关键的作用。高质量的肠道准备是肠镜下视野清晰的必要条件,能够大大降低漏诊率和不必要的重复检查。目前常用的方法有口服药物法和灌肠法。由于临床上单独使用灌肠法仍无法满足结肠镜检查的要求,所以用得最多的是口服药物法(灌肠法一般仅用于不能口服泻药或口服泻药失败后的补救措施)。目前国内常用的口服药物有聚乙二醇电解质(聚乙二醇4000(60g)、无水硫酸钠、氯化钠、氯化钾、碳酸氢钠)、硫酸镁、磷酸钠盐、番泻叶、甘露醇等。硫酸钠硫酸钾硫酸镁口服溶液主要用于进行结肠镜检查成人患者的肠道内容物清除,原研公司为Braintree Labs,商品名为SUPREP BOWEL PREP KIT,于2010年08月05日获得FDA的批准上市。本次NOVEL LABS INC于2017年02月23日获得FDA批准的首仿制剂。
4
ANDA批准清单

注:因信息量较大,内容难免有差错,北京凯瑞科德真诚期待各位同行的交流与探讨、批评与建议。谢谢!