


口服固体制剂的一致性评价正在如火如荼的进行,液体制剂的一致性评价如期而至,在一致性评价的大背景下,杂质研究必不可少,如何科学合理适度的进行杂质研究成为了行业人士关注的焦点,结合我公司进行的多个一致性评价的品种,我们小结了杂质研究的策略,希望给各位同仁提供一种杂质研究的思路。
杂质研究的重要性:
原料药合成工艺及贮存的稳定性 分析方法的可靠准确
药物制剂工艺及贮存的稳定性 药品的安全有效。
杂质研究多少个算充分?
例如:某一普通口服片剂进口质量标准中收载了15个已知杂质,并制定了每一杂质限度。很多同仁唯进口质量标准或国外药典马首是瞻,花费大量人力和物理资源去设法获得那15 个杂质,最终研究结果显示在仿制原料药和仿制制剂中仅有1~2个杂质含量在报告限以上、鉴定限以下,其余均是未检出,这样的研究就简单粗暴,属于重拳打在棉花上,费时费力而且很可能研究不充分。
又如某厂家福沙匹坦二甲葡胺原料药合成工艺中最后一步反应又到了重金属Pd,厂家进行了原料药中Pd含量检测,发现确实存在Pd残留10ppm,如果仅以重金属残留或炽灼残渣来控制显然是不科学的,必须单独建立Pd残留的检测方法并验证,根据EMEA/CHMP和FDA相关指导原则,因福沙匹坦二甲葡胺最终制剂为注射剂,显然10ppm的限度使不合理的,根据TTC或PDE法计算限度更加合适,或者限度控制在1ppm更加合理。
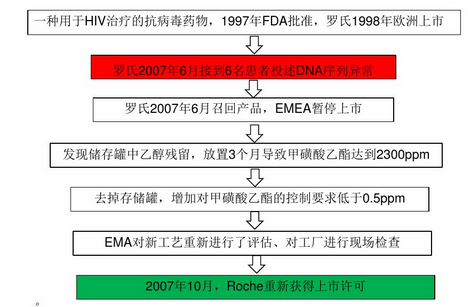
甲磺酸奈非那非(维拉赛特锭)事件:
杂质研究策略:
1. 查询原研说明书,各国药典,TLC,LGC等杂质网站等资料,初步确定品种杂质情况;
2. 测定至少3批原研制剂(尤其近有效期的批次)的杂质谱;
3. 测定3批规模化生产的仿制原料药与仿制制剂样品,并通过稳定性研究重点控制原料药和制剂过程中的降解杂质;
4. 根据原料药合成及制剂工艺,确定最后一步骤可能引入终产品的杂质。
5. 异构体杂质,尤其对映异构体杂质因单独控制,而不应通过旋光的形式控制;
6. 如果原料药结构中存在潜在基因毒性杂质及其警示结构,重点关注原料药的附产物及降解杂质,关注杂质的药理毒理学资料,并通过LC-MS,GC-MS确定限度;
7. 如果品种存在多晶型现象,还需重点关注晶型杂质,尤其稳定性差的晶型更应重点关注原料药及制剂中进行的稳定性及晶型的转变;
8. 根据以上研究结果,最终质量标准中无需制订有关物质检查项,同时制定杂质风险评估与控制策略树。(甚至可以采取更为大胆的做法,如果主成分规格很小(如滴眼液,单剂量在毫克级或微克级),杂质与残留溶剂均无需研究,只需在申报材料中阐明“经推算这些物质的每日最高摄入量均小于每日临床安全摄入限度”即可。)
总之,药品杂质研究贯穿原料药工艺、制剂工艺和稳定性研究的各个阶段,如何科学、合理的进行研究,仁者见仁,智者见智,正所谓从实践中来,到实践中去。欢迎感兴趣的朋友互动交流。
另外,我公司长期从事杂质CRO业务和液质对外检测服务,欢迎感兴趣的同仁交流合作QQ:2697288927
相关技术指导原则:
化学药物杂质研究的技术指导原则
化学药物质量控制分析方法验证技术指导原则
已有国家标准化学药品研究技术指导原则
ANDAs: Impurities in Drug Substances,FDA
ANDAs: Impurities in Drug Products,FDA
ICH Q2A Text on Validation of Analytical Procedures
ICH Q2B Validation of Analytical Procedures:Methodology
ICH Q3A Impurities in New Drug Substances
ICH Q3B Impurities in New Drug Products
ICH 3C Guideline for Residual Solvents
ICH M7 Assessment and Control of DNA Reactive(Mutagenic)Impurities in Pharmaceuticals to Limit Potential Carcinogenic Risk
Guideline on the limits of genotoxic impurities ,EMEA/ CHMP
Guidance for Industry, Genotoxic and Carcinogenic Impurities in Drug Substances and Products: Recommended Approaches ,FDA
Guideline on the Specification Limits for Residues of Metal Catalysts or Metal Reagents,EMEA/ CHMP